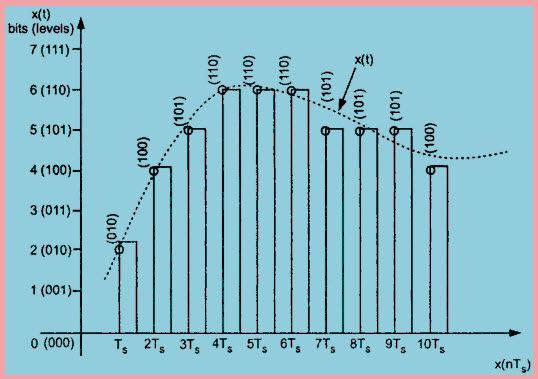
Sucha komórka to najprostsza forma źródła energii elektrycznej. Wiele ogniw połączonych razem tworzy baterię. Plik kwas ołowiowy lub nikiel-kadm bateria to zaawansowana wersja dry cell. Ogniwo to zostało po raz pierwszy wynalezione przez francuskiego inżyniera Georgesa Leclanche'a w 1866 roku. Jego wynalazek został nazwany jego imieniem jako bateria Leclanche. Ale w tym czasie był bardzo ciężki i można go było łatwo złamać. Suche ogniwo ma tę samą zasadę i jest zaawansowaną wersją baterii Leclanche i jest dostępne w różnych napięciach i rozmiarach. Handlowa forma ogniwa cynkowo-węglowego, która jest zmodyfikowaną formą baterii Leclanche, została wynaleziona w 1881 roku przez Carla Gassnera z Moguncji. Jest produkowany w dużych ilościach i używany w wielu zastosowaniach, takich jak zabawki, radia, kalkulatory itp.
Co to jest sucha komórka?
Sucha komórka to urządzenie wytwarzające energię elektryczną w oparciu o reakcje chemiczne. Kiedy dwie elektrody ogniwa są połączone zamkniętą ścieżką, komórka zmusza elektrony do przepływu z jednego końca na drugi. Przepływ elektronów powoduje przepływ prądu w obwodzie zamkniętym.

Suche warstwy komórek
Przy pomocy reakcji chemicznych elektrony przepływają z jednego końca na drugi. Gdy dwa lub więcej ogniw, połączonych z prawidłową polaryzacją, przepływa więcej elektronów z powodu wysokiego potencjału. Ta kombinacja nazywa się baterią. Od minimalnego napięcia 1,5 V do 100 V, akumulator może być używany do uzyskania różnych napięć. Nawet wyjściowe napięcie DC akumulatora można regulować na różnych poziomach za pomocą takich przetworników energoelektronicznych, jak siekacz obwody.
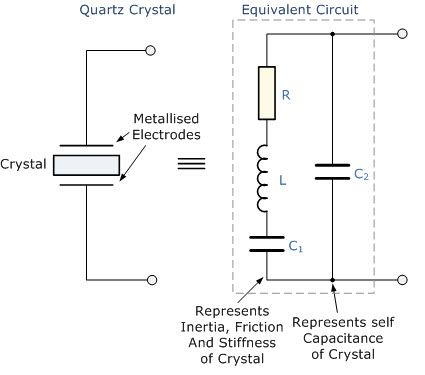
Struktura komórki
Strukturę suchego ogniwa cynkowo-węglowego pokazano na rysunku. Składa się z końcówki anodowej wykonanej z cynku lub ogólnie pręta grafitowego. Węgiel tworzy końcówkę katody. Można zauważyć, że w starszych wersjach ogniwa suchego cynk był używany jako katoda, a grafit jako końcówkę anody. Wybór pierwiastków jest zasadniczo oparty na ich konfiguracji chemicznej na najbardziej zewnętrznej orbicie pierwiastków.

Struktura suchej komórki
Jeśli ma więcej elektronów liczbowych na najbardziej zewnętrznej orbicie, może działać jako dawca, a tym samym tworzy katodę. Podobnie, jeśli najbardziej zewnętrzna orbita ma mniej elektronów, może łatwo przyjąć, a tym samym utworzyć anodę. Elektrolit umieszczony pomiędzy nimi działa jak katalizator reakcji chemicznych. Generalnie jako elektrolit używamy galaretki z chlorkiem amonu. Na przedstawionym rysunku zastosowany elektrolit to mieszanina cynku i chlorków. Jako elektrolit stosuje się również chlorek sodu. Wokół pręta anodowego otoczona jest mieszanina dwutlenku manganu i węgla.
Cała konfiguracja jest umieszczona w metalowej tubie. Galaretka jest chroniona przed wysychaniem dzięki zastosowaniu smoły na szczycie komórki. Na dole umieszczona jest podkładka węglowa. Celem tej podkładki jest zapobieganie zetknięciu się pręta anody cynkowej z pojemnikiem.
Nazywa się to również przekładką, jak pokazano na schemacie. Puszka cynkowa jest również otoczona izolacją papierową w celach izolacyjnych. W przypadku dużych baterii stosuje się również inne materiały izolacyjne, takie jak mika itp. U góry utworzony jest biegun dodatni łokcia. U podstawy jest utworzony biegun ujemny komórki.
Działanie Dry Cell
Sucha komórka działa zasadniczo na reakcjach chemicznych. Ze względu na reakcje, które zachodzą między elektrolitem a elektrodami, elektrony przepływają z jednej elektrody na drugą. Substancje, takie jak kwasy, rozpuszczają się w wodzie, tworząc zjonizowane cząsteczki. Zjonizowana cząstka jest dwojakiego rodzaju. Jony dodatnie nazywane są kationami, a jony ujemne - anionami. Kwasy rozpuszczone w wodzie nazywane są elektrolitami.
Na powyższym schemacie jako elektrolit tworzy się chlorek cynku. Podobnie galaretka z chlorkiem amonu tworzy się również jako elektrolit. Metalowe pręty zanurzone w elektrolitach tworzą elektrody. Bazując na właściwościach chemicznych metalowych prętów, mamy elektrodę dodatnią jako anodę i elektrodę ujemną jako katodę.
Elektrody przyciągają przeciwnie naładowane jony na swoją stronę. Na przykład katoda przyciąga aniony, a anoda - kationy. W tym procesie elektrony przepływają z jednego kierunku na drugi, stąd przepływ ładunków. To się nazywa obecny .
Reakcje chemiczne
Poniżej pokazano reakcje zachodzące w komórce. Pierwsza to reakcja utleniania.

W tym przypadku katoda cynkowa jest utleniana do dodatnio naładowanych jonów cynku, uwalniając dwa jony. Te elektrony są zbierane przez anodę. Potem następuje reakcja redukcji.

Reakcję redukcji na anodzie pokazano powyżej. Ta reakcja wytwarza prąd elektryczny. Uwalnia jony tlenkowe z tlenkiem magnezu. Ta reakcja zachodzi, gdy magnez łączy się z elektrolitem.


Pozostałe dwie reakcje reprezentują reakcję kwasowo-zasadową i reakcję wytrącania zachodzącą w suchej komorze. W reakcji kwasowo-zasadowej NH łączy się z OH w celu wytworzenia NH3 wraz z wodą. Wyniki to NH3 i baza wodna.
Różnica między komórką suchą i mokrą
Główną różnicą między suchym a mokrym ogniwem jest forma elektrolitu. Jak omówiono wcześniej, w suchym ogniwie elektrolit, taki jak chlorek amonu, jest z natury suchy. Takie suche ogniwa są bardziej powszechne i używane w zabawkach, radiach itp. Ale w mokrym ogniwie elektrolit jest w stanie ciekłym.
Stosuje się płynne elektrolity, takie jak kwas siarkowy, który jest niebezpieczną cieczą korozyjną. Ze względu na charakter takich cieczy, mokre ogniwo ma bardziej wybuchowy charakter i należy się z nim obchodzić ostrożnie. Największą zaletą takich mokrych ogniw jest to, że można je łatwo ładować i używać do wielu zastosowań. Takie baterie znajdują powszechne zastosowanie w lotnictwie, mediach, magazynach energii i wieżach telefonii komórkowej.
Funkcje suchego ogniwa
Funkcja suchego ogniwa opiera się na reakcjach chemicznych między elektrodą a elektrolitami. Umieszczenie elektrod w elektrolitach przyciąga do siebie przeciwnie naładowane jony. Powoduje to przepływ ładunków, a tym samym wytwarzanie prądu.
Zalety
Plik zalety suchego ogniwa obejmują następujące elementy.
- Sucha komórka ma wiele zalet, takich jak
- Jest mały.
- Może mieć różne poziomy napięcia.
- Jest poręczny i ma liczne zastosowania.
- Jest to jedyne źródło napięcia stałego.
- Może być używany wraz z obwodami elektronicznymi mocy do regulacji napięcia wyjściowego
- Jest ładowalna.
Niedogodności
Plik wady suchej komórki obejmują następujące elementy.
- Należy obchodzić się z nim ostrożnie
- Jest wybuchowy
- Akumulatory o dużej pojemności są bardzo ciężkie
Aplikacje
Plik zastosowania suchej komórki obejmują następujące elementy.
- Zabawki
- Lotnictwo
- Telefony komórkowe
- Radio
- Kalkulator
- Zegarki
- Aparaty słuchowe
Dlatego widzieliśmy działanie, klasyfikację i zastosowania suche komórki . Warto zauważyć, że bateria działa tylko wtedy, gdy elektrody są ze sobą w fizycznym kontakcie. Pomiędzy elektrodami musi istnieć medium przewodzące. Pytanie brzmi, czy woda może być używana jako medium przewodzące między elektrodami suchego ogniwa? W takim razie co się stanie, jeśli ta komórka zostanie zanurzona w wodzie?